A periódusos rendszer a kémiai elemek elrendezése, amely rendszámuk, elektronkonfigurációjuk és ismétlődő kémiai tulajdonságaik alapján épül fel. Az alapformában az elemek növekvő rendszámú sorrendben, az olvasási sorrendben jelennek meg. Ezután sorok és oszlopok jönnek létre új sorok indításával és üres cellák beszúrásával, így a sorok (pontok) és oszlopok (csoportok) ismétlődő tulajdonságú elemeket (úgynevezett periodicitást) mutatnak. Például a 18. csoport (oszlop) összes eleme nemesgáz, amely nagyrészt – bár nem teljesen – reakcióképtelen.
A periódusos rendszer története több mint két évszázados növekedést tükröz az elemek kémiai és fizikai tulajdonságainak megértésében.
1863-ban 56 elemet ismertek, és évente körülbelül egy új elemet fedeztek fel. Más tudósok korábban azonosították az elemek periodicitását. John Newlands leírta az oktávok törvényét, 1864-ben megjegyezte periodicitásukat a relatív atomtömeg szerint, majd 1865-ben publikálta. Javaslata azonosította az új elemek, például a germánium lehetőségét. A koncepciót bírálták, és újítását a Vegyészek Társasága csak 1887-ben ismerte el. A periódusos rendszert javasolt másik személy Lothar Meyer volt, aki 1864-ben publikált egy tanulmányt, amelyben 28 elemet ír le vegyértékük szerint osztályozva, de új előrejelzések nélkül. elemeket.
Miután 1867-ben tanár lett, Mengyelejev megírta a Kémia alapelveit, amely korának meghatározó tankönyvévé vált. Két kötetben jelent meg 1868 és 1870 között. Ekkor tette meg legfontosabb felfedezését. Miközben megpróbálta osztályozni az elemeket kémiai tulajdonságaik szerint, olyan mintákat vett észre, amelyek a periódusos rendszer felállításához vezették. Azt állította, hogy álmában elképzelte az elemek teljes elrendezését:
„Álmomban láttam egy asztalt, ahol minden elem szükség szerint a helyére került. Ébredés után azonnal felírtam egy papírra, csak egy helyen tűnt később szükségesnek a javítás.”
A mintát követő további elemek hozzáadásával Mengyelejev kifejlesztette a periódusos rendszer kiterjesztett változatát. 1869. március 6-án hivatalos prezentációt tartott az Orosz Kémiai Társaságnak „Az elemek atomi tömegének tulajdonságai közötti függés” címmel, amelyben az elemeket az atomsúly (ma relatív atomtömeg) és a vegyérték alapján is leírta. Ez az előadás kimondta:
- Az elemek, ha atomtömegük szerint vannak elrendezve, a tulajdonságok látszólagos periodicitását mutatják.
- A kémiai tulajdonságaikat tekintve hasonló elemeknek vagy hasonló az atomtömege (pl. Pt, Ir, Os), vagy rendesen növekszik az atomtömegük (pl. K, Rb, Cs).
- Az elemek elemcsoportokba való elrendezése atomtömegük sorrendjében megfelel az úgynevezett vegyértékeiknek, valamint bizonyos mértékig jellegzetes kémiai tulajdonságaiknak; amint az a Li, Be, B, C, N, O és F sorozatok többi sorozatából is kitűnik.
- A legszélesebb körben elterjedt elemek kis atomsúlyúak.
- Az atomtömeg nagysága határozza meg az elem karakterét, ahogyan a molekula nagysága határozza meg az összetett test karakterét.
- Sok, még ismeretlen elem felfedezésére kell számítanunk – például két, az alumíniumhoz és a szilíciumhoz hasonló elem, amelyek atomtömege 65 és 75 között lenne.
- Egy elem atomtömege néha módosítható a szomszédos elemeinek ismeretével. Így a tellúr atomtömege 123 és 126 között kell hogy legyen, és nem lehet 128. (A tellúr atomtömege 127,6, és Mengyelejev tévedett abban a feltételezésében, hogy az atomtömegnek a pozícióval egy perióduson belül növekednie kell.)
- Az elemek bizonyos jellemző tulajdonságai atomtömegükből megjósolhatók.
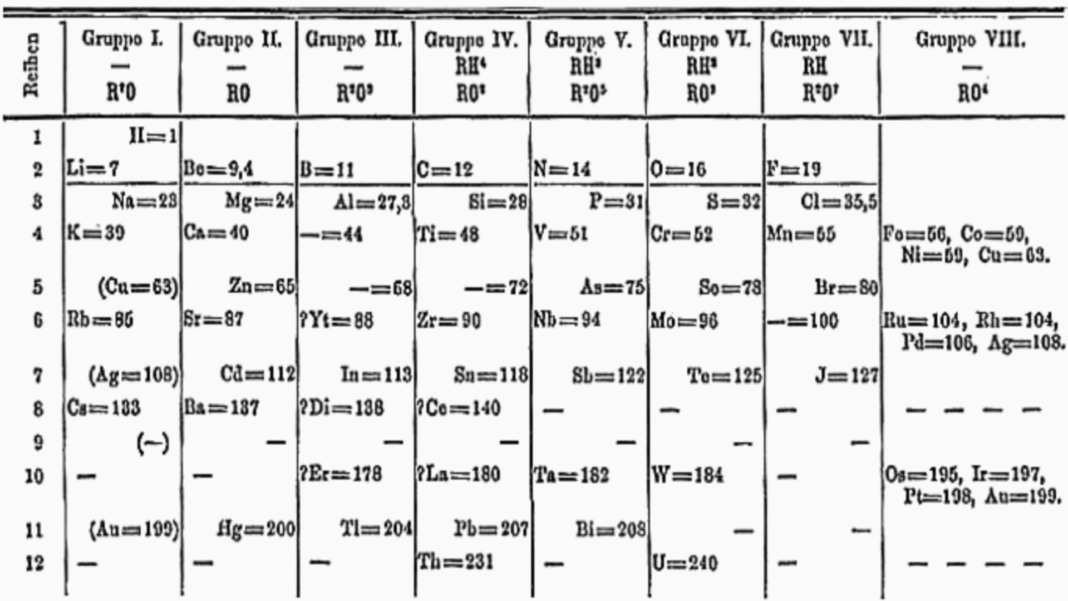
Mengyelejev közzétette az összes ismert elemet tartalmazó periódusos táblázatát egy orosz nyelvű folyóiratban, és számos új elemet jósolt a táblázat kiegészítésére . Alig néhány hónappal később Meyer egy gyakorlatilag azonos táblázatot publikált egy német nyelvű folyóiratban. Mengyelejev táblázatának abban különbözik, hogy pontosan megjósolja az általa ekasiliconnak, ekaaaluniumnak és ekaboronnak nevezett elemek tulajdonságait (germánium, gallium és szkandium).
Mengyelejev néhány ismert elem tulajdonságainak megváltoztatását is javasolta. Munkája előtt az urán vegyértéke 3, atomtömege pedig körülbelül 120 volt. Mengyelejev rájött, hogy ezek az értékek nem férnek bele a periódusos rendszerébe, és megduplázta mind a 6-os vegyértéket, mind a 240-es atomtömeget (közel a mai 238-as értékhez).
Megjósolt három eleméhez az eka, dvi és tri (szanszkrit egy, kettő, három) előtagokat használta elnevezésükben. Mengyelejev megkérdőjelezte a jelenleg elfogadott atomsúlyok némelyikét (ezeket akkoriban csak viszonylag kis pontossággal lehetett mérni), rámutatva, hogy ezek nem felelnek meg a periódusos törvénye által javasoltaknak. Megjegyezte, hogy a tellúrnak nagyobb az atomtömege, mint a jódnak, de helyes sorrendbe helyezte őket, tévesen jósolta meg, hogy az akkor elfogadott atomsúlyok hibásak. Elgondolkodott azon, hogy hova tegye az ismert lantanoidákat, és megjósolta egy másik sor létezését az asztalon, amelyek a legnehezebb atomsúlyú aktinoidák. Egyesek elutasították Mengyelejevet, mert azt jósolta, hogy több elem lesz, de bebizonyosodott, hogy igaza volt, amikor 1875-ben Ga (gallium) és 1886-ban Ge (germánium) felfedezésre került, amelyek tökéletesen illeszkedtek a két hiányzó helyre.
Azzal, hogy a szanszkrit előtagokat használta a „hiányzó” elemek megnevezésére, Mengyelejev feljegyezhette adósságát az ókori India szanszkrit nyelvtudósai felé, akik kifinomult nyelvelméleteket hoztak létre a beszédhangok kétdimenziós mintáinak felfedezése alapján.
A Mengyelejev által készített eredeti tervezetet évekkel később találták meg, és Tentative System of Elements néven tették közzé.
Dmitrij Mengyelejevet gyakran a periódusos rendszer atyjaként emlegetik. Táblázatát vagy mátrixát „periodikus rendszernek” nevezte.